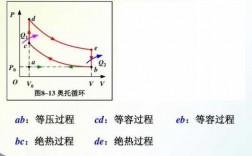
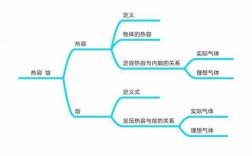
本篇目录:
焓是与内能有关的物理量怎么理解?
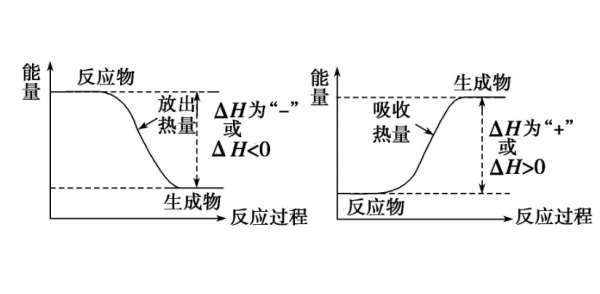
焓是与内能有关的物理量,符号用H表示,反应在一定条件下是吸热还是放热由生成物和反应物的焓值差即焓变(△H)决定的,恒压条件下的反应热等于焓变。单位一般采用kJ/mol。
焓变△H:即物体焓的变化量。焓是物体的一个热力学能状态函数,即热焓。焓变是生成物与反应物的焓值差。作为一个描述系统状态的状态函数,ΔH(焓变)表示的是系统发生一个过程的焓的增量。
U:内能,通常指热力学系统,即大量分子构成的宏观物质系统的热运动能量。其中包括系统内部所有分子的无规则运动动能和分子间相互作用势能。广义地说,内能是系统内部一切运动形式的能量总和。
焓的定义如下:热力学中,焓(Enthalpy)是一个基本的物理量,通常用符号H表示,表示一个系统所具有的内能、压强和体积等因素的综合体现。
焓是一个状态函数,也就是说,系统的状态一定,焓的值就确定。焓的定义式(焓没有实际的物理意义,但是它有操作意义。
焓变和内能有什么区别?
1、因此,可以看出,在恒压条件下,焓变化(△H)比内能变化(△U)更大,因为它包括了体积做功的能量贡献。而在恒容条件下,内能变化(△U)等于焓变化(△H)减去体积做功的能量贡献。

2、体系的内能(Internal Energy)和焓变(Enthalpy Change)是热力学中的两个不同概念,它们之间有一定的关系,但并不总是相等。
3、焓变△H:即物体焓的变化量。焓是物体的一个热力学能状态函数,即热焓。焓变是生成物与反应物的焓值差。作为一个描述系统状态的状态函数,ΔH(焓变)表示的是系统发生一个过程的焓的增量。
4、分。严格物理学者,会区别使用符号:dH 是对焓的微 分,而 δQ 表示的不是对热能、热量的微分,仅仅只是 微小的热流而已。大大咧咧的、牵强附会的、胡言乱语 的、虚张声势的教师们是不懂也不屑这些区分的。
5、其中U表示热力学能,也称为内能(Internal Energy),即系统内部的所有能量;p是系统的压力(Pressure),V是系统的体积(Volume)。而焓变是生成物与反应物的焓值差。作为一个描述系统状态的状态函数,焓变没有明确的物理意义。
6、化学么? 焓是一个状态函数,也就是说,系统的状态一定,焓的值就定了。
焓与内能的区别???
1、焓变和内能区别为:性质不同、主次不同、固定性不同。性质不同 焓变:是生成物与反应物的焓值差。内能:是分子无规则运动能量总和的统计平均值。
2、即:△U = △H - PΔV 因此,可以看出,在恒压条件下,焓变化(△H)比内能变化(△U)更大,因为它包括了体积做功的能量贡献。而在恒容条件下,内能变化(△U)等于焓变化(△H)减去体积做功的能量贡献。
3、焓定义为H=U+pV,式中U为物质的内能,p为压力,V为体积。焓的物理意义是体系中热力学能再附加上PV这部分能量的一种能量。
4、体系的内能(Internal Energy)和焓变(Enthalpy Change)是热力学中的两个不同概念,它们之间有一定的关系,但并不总是相等。
5、一个系统中的热力作用,等于该系统内能加上其体积与外界作用于该系统的压强的乘积的总和。
焓是什么呢焓是物质总能量吗还是物质内能?
焓定义为H=U+pV,式中U为物质的内能,p为压力,V为体积。焓的物理意义是体系中热力学能再附加上PV这部分能量的一种能量。
焓是热力学中表示物质系统能量的一个状态函数,用符号H表示,H=U+pV。H=U+PV,我们对H求偏导,dH=dU+PdV+VdP=Q+dW+PdV+VdP,又dW=-pdV,所以dH=Q+vdp,那么在等压条件下项vdp=0,故dH=Q。
焓是一个热力学概念,用于描述物质系统能量的状态,焓就是系统中所有能量的一种度量,包括分子动能、分子间势能、内能等所有形式的能量。在化学反应中,焓变是指反应前后系统焓的增量。
焓的意思是热力学中一个很重要的物理量,它表示热量和压力的乘积,也可以理解为热力学系统的总能量。焓的定义:焓是系统的内能与对外界的功之和,通常用符号H表示。
U:内能,通常指热力学系统,即大量分子构成的宏观物质系统的热运动能量。其中包括系统内部所有分子的无规则运动动能和分子间相互作用势能。广义地说,内能是系统内部一切运动形式的能量总和。
摩尔焓 Hm(单位:千焦/摩尔KJ/mol)和特别焓 h(单位:千焦/千克 KJ/Kg)也非常重要,它们描述了焓在物质的量 n 和物质质量 m 上的定义。焓是内能和体积的勒让德变换。它是SpN总合的热势能。
焓变与内能变化的关系是什么?
因此,可以看出,在恒压条件下,焓变化(△H)比内能变化(△U)更大,因为它包括了体积做功的能量贡献。而在恒容条件下,内能变化(△U)等于焓变化(△H)减去体积做功的能量贡献。
焓变是指在恒压过程中,体系能量从始态到终态的变化,即焓是内能在恒压条件下的一个表现形式。焓变通常用来描述化学反应或相变过程中体系能量变化的一个量。
化学么? 焓是一个状态函数,也就是说,系统的状态一定,焓的值就定了。
体系的内能等于焓变吗?
1、焓是一个状态函数,也就是说,系统的状态一定,焓的值就定了。
2、焓是与内能有关的物理量,符号用H表示,反应在一定条件下是吸热还是放热由生成物和反应物的焓值差即焓变(△H)决定的,恒压条件下的反应热等于焓变。单位一般采用kJ/mol。
3、因此,可以看出,在恒压条件下,焓变化(△H)比内能变化(△U)更大,因为它包括了体积做功的能量贡献。而在恒容条件下,内能变化(△U)等于焓变化(△H)减去体积做功的能量贡献。
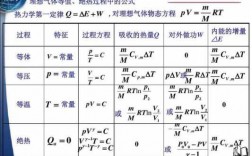
4、即H=U+pV 解读为: 焓=流动内能+推动功,其中U表示热力学能,也称为内能,即系统内部的所有能量;p是系统的压强,V是系统的体积 。所以:ΔH=ΔU+Δ(pV)在恒压条件下,ΔH(焓变)数值上等于恒压反应热。
到此,以上就是小编对于等容过程焓变和内能一样吗的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏