本篇目录:
- 1、问什么只要配制NaA溶液,在常温下测得其PH大于7,即证明HA是弱电解...
- 2、HA电离方程式
- 3、高中化学知识点弱电解质的电离平衡
- 4、求详细过程,谢谢各位
- 5、影响弱电解质电离平衡的因素有哪些
问什么只要配制NaA溶液,在常温下测得其PH大于7,即证明HA是弱电解...
因为NaA是盐,由HA酸生成的盐,假设NaA在水解后溶液呈中性,那题中的混合液就是中性盐和HA酸的混合液,溶液应该呈现酸性 PH7。实际PH7 说明水中的HO-要多于H+。
PH=7,一般情况下NaA是强酸强碱盐。A不会水解,有一特例,醋酸铵的PH=7,但为弱酸弱碱盐,需记住。PH大于7说明是强碱弱酸盐,确切的说应该是盐中的碱的Kb值比酸的Ka值大,即酸根比碱根更易水解,显碱性。
你好,很高兴为你解答 PH=7,说明NaA是强酸强碱盐。A不会水解 PH大于7说明是强碱弱酸盐,酸式酸根水解,显碱性。
已知用实验确定某酸HA是弱电解质。两同学的方案是:甲:① 称取一定质量的HA配制0.l mol / L的溶液100 mL;② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
HA电离方程式
所以HA的电离方程式为HA H + +A - 。(2) ,由于c(HA)=0. 1 mol/LHA溶液中,解得c(H + )=10 -4 mol/L。
因为PH=2,说明溶液是酸性的.它的电离是HA-=H++A2-(可逆,产生氢离子)而水解是:HA-+H2O=H2A+OH-(可逆,产生氢氧根)溶液呈酸性,说明电离产生的氢离子比水解产生的氢氧根多啊,就是电离程度大于水解程度了。
因为有电离平衡存在: HA =H+ + A- 加入NaA固体,NaA = Na+ + A- (完全电离) 增大了A-的浓度,平衡向左移动。
具体情况具体分析了。多数情况下是双水解的盐pH更接近于7,但也有反例。
NaHA可能呈现碱性也可能呈现酸性,这需要看HA-的水解和电离程度哪个大一些。这种情况下,实际上比较NaHA和3的缓冲液的酸碱性是比较困难的。先算NaHA的酸碱性。
高中化学知识点弱电解质的电离平衡
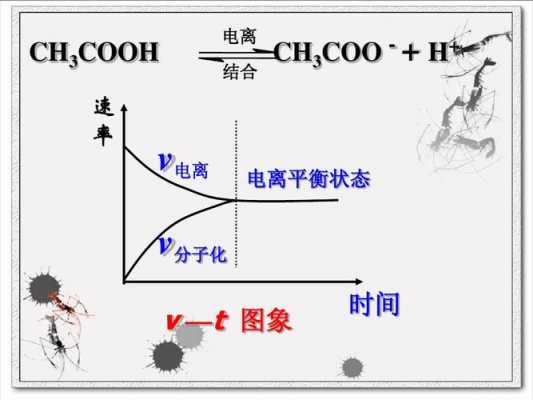
1、高中化学电离平衡知识点:电离 电离是电解质溶于水或在熔融状态下,离解成自由移动的离子的过程。这里的电解质可以是强电解质也可以是弱电解质。我们今天要讲的电离平衡它就是相对于弱电解质来说的。
2、弱电解质才有电离平衡,如水:2H2O =H3O++OH-。电离平衡的特征:等(V电离=V结合≠0)动(动态平衡)定(各微粒浓度一定)变 影响电离平衡的外界条件:温度越高,浓度越小,越有利于电离。
3、电解质和非电解质:在水溶液中或熔融状态时是否能够导电的化合物。强电解质与弱电解质:在水溶液中能否完全电离的电解质;与溶解度和导电能力无关。
求详细过程,谢谢各位
(1)根据图像可知,当加入13mlHA时,HA是过量的,但溶液显中性,这说明MOH一定是强碱,而HA是弱酸,则MOH在水溶液中的电离方程式为MOH=M+ + OH-。
(1)若m为正整数,所以只有m=1,原方程变为4x-4x+1=0,此时方程的根为x1=x2=1/2。(2)根据根与系数的关系,有ab=m/4。
解:设从甲地到乙地平路为xkm,坡路为ykm 全程为(x+y)km 根据题意得[图片] 整理得[图片] 解这个方程组得[图片] 所以x+y=5 从甲地到乙地全程是5 km。
(1)匀速直线,拉力与磨擦力平衡,小车受到摩擦力大小30N,方向与拉力方向相反 (2)校车要减速前行直至停下来,减速过程中合力大小:20N方向与拉力方向相反;停下来以后,合力为零。
狗骨头用温水清洗后放入容器中,然后倒入65°白酒(骨头全部浸泡在酒中),至少15天后饮用。追问:狗骨头 还用剁成小块吗?一斤白酒泡多少骨头?不用剁成小块,1斤 白酒 6两骨头。
影响弱电解质电离平衡的因素有哪些
1、影响电离平衡的因素 浓度:浓度越大,电离程度越小。在稀释溶液时,电离平衡向右移动,而离子浓度会减小。温度:温度越高,电离程度越大。因电离过程是吸热过程,升温时平衡向右移动。
2、影响电离平衡的因素:温度升高,促进电离的进行(电离反应都是吸热反应)。浓度降低,弱电解质浓度降低会使电离程度增大。同离子效应,如果加入与弱电解质相同的离子,会抑制电离。
3、影响电离平衡的因素:温度T升高,促进电离平衡。同离子效应,即加与弱电解质电离出相同的离子就抑制电离平衡,如加H+或CH3COO-。加与离子反应的物质,促进电离平衡,如加金属Na。越稀越电离。
4、决定强、弱电解质的因素 决定强、弱电解质的因素较多,有时一种物质在某种情况下是强电解质,而在另一种情况下,又可以是弱电解质。下面从键型、键能、溶解度、浓度和溶剂等方面来讨论这些因素对电解质电离的影响。
5、弱电解质的电离平衡有一个平衡常数,这个平衡常数受温度影响,温度越高,平衡常数越大,电离程度越大,这是个内因。外因有:浓度,溶剂等。与平衡的移动一样,改变影响平衡的一个因素,平衡向减弱这个改变的方向移动。
到此,以上就是小编对于ha电离过程中体系各粒子浓度的变化的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏