本篇目录:
电解食盐水若产生2g氢气,则转移了几摩尔电子,电子数是多少?
1、对。2g氢气就是1mol,那么由氢离子生成氢气,肯定转移了2mol电子。
2、电解饱和食盐水电子转移的方向Cl→H,数目2e-。2NaCl+2H2OCl2↑+H2↑+2NaOH,方程式中Cl从-1→0,失去电子,H从+1→0得到电子,故电子转移的方向Cl→H,数目2e-。
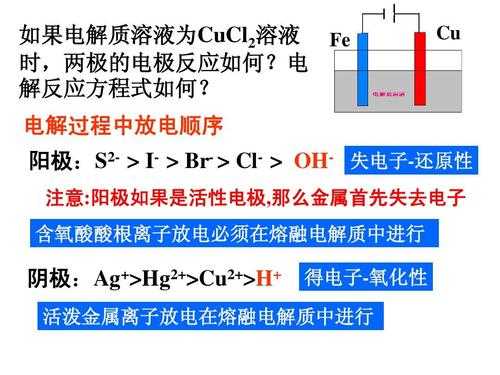
3、观察氧化还原反应每进行一摩尔会转移多少摩尔的电子,然后用这个值乘上这个化学反应进行了几摩尔。至于第一步具体怎么做,那就请在化学方程式中标出各个元素的化合价,然后通过反应前后的化合价变化来判断转移电子数。
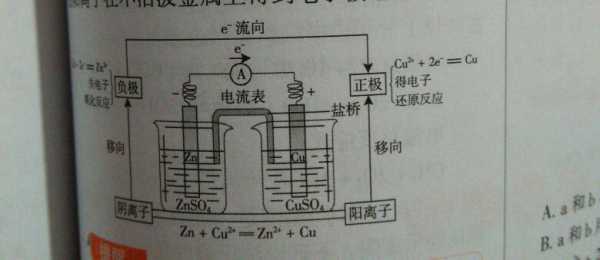
电化学,求转移电子数
1、mol的阴极反应,消耗1molCu+,转移2mol电子。此时阳极反应0.5mol。1mol阳极反应,消耗2molHO,转移4mol电子。此时阴极反应2mol。1mol总反应,消耗2molCu+和2molHO,转移4mol电子。
2、因此每电解1mol的H2O转移电子数为2mol。故当有0.05mol水被电解时,转移电子数就为0.1mol。
3、E=2E两个电池的电池总反应式是相同的,只是第一个电池转移电子数Z=2,第二个电池转移电子数Z=1。
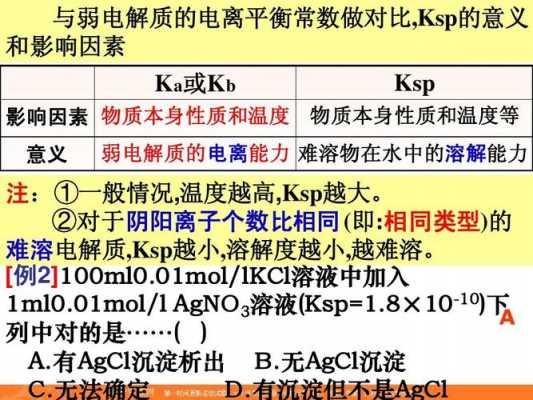
电解熔融氧化铝有多少个电子转移
电解熔融的氧化铝al2o3,摩尔质量是102,1mol铝离子变成铝,就需要转移3mol的电子。
有4个再变,所以转移的电子数就是3*4=12,也就是说生成4mol铝,就转移12mol电子,现在转移0.3mol电子,你说生成好多铝呢?(0.1mol,就是7g),所以0.3mol不是对应12mol电子,只是一个比例关系而已。
标况下氧气24L,那么生成氧气1mol,方程式中氧气系数为3,那么三氧化二铝(氧化铝)消耗了2/3mol,氧化铝相对分子质量为102,那么消耗氧化铝质量为102X2/3=68g。
...当两极共收集到气体336mL时,电路中转移的电子数为多少
电解的硫酸钠溶液即电解水:2H2O==2H2+O2。
在336mL气体中,V(H2)=2/3*336ml=224ml,n(H2)=0.224L/24L/mol=0.01mol,V(O2)=336ml-224ml=112ml ,n(O2)=0.112L/24L/mol=0.005mol。
(1) 正 。(2) Ag , 16 g。(3)2∶ 2 ∶ ∶ 1 。
在c、d两极共收集到336ml(标准状况)气体,即H2与O2共0.336L÷24L/mol=0.015mol,也即电解0.01mol水。
,电解后加入0.1molCuO溶液就恢复原来的状态,那么被电解的Cu2+就是0.1mol,所以转移电子数就是0.2mol。
到此,以上就是小编对于电解质中的电子是怎么移动的的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏