本篇目录:
- 1、熵增反应一定自发进行吗,熵减反应一定不能自发进行么
- 2、思维模型六十一:反熵增
- 3、熵增加的反应一定是自发的吗?
- 4、常见的熵增反应有哪些?
- 5、熵增加的反应一定是自发的吗
- 6、“熵值增大的反应都能自发进行”为什么是错的?
熵增反应一定自发进行吗,熵减反应一定不能自发进行么
因为“对于吸热、熵增的化学反应,高温有利于反应的正向自发进行”,这是一个理论的、定性的说法。
自由能△G=△H-△S×T,△H为焓变,△S为熵变。当自由能小于0,反应能够自发;自由能大于0,反应不能自发。可以看出,焓减、熵增有利于反应自发。
根据吉布斯自由能方程:△G=△H-T△S,反应要想自发进行,则要求:△G0,即:△H-T△S0。而熵增代表△S 0;放热代表:△H0;结合起来看,△G一定是小于0的,即反应一定自发。
思维模型六十一:反熵增
1、反熵增就是以上定义的相反面了。 一个系统,一个组织,一个星期,一个宇宙,再到一个人都符合熵增定律。我们会变得混乱,无序,僵化,没有活力直到在这种混乱中走向消亡。
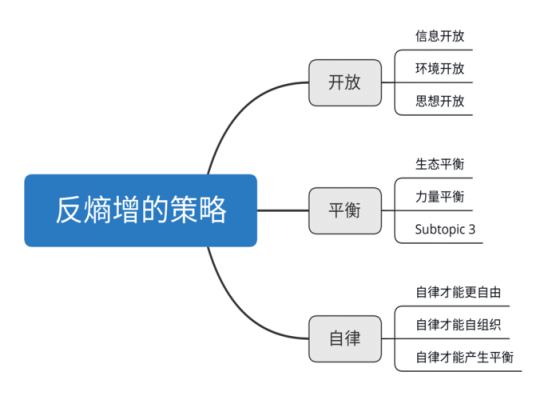
2、值得庆幸的是,宇宙是平衡的,在熵增的大前提下,给了我们一条不同的路,反熵增,也即自组织、生命化。亚马逊的CEO贝佐斯对于反熵增的理解非常深刻。
3、简单来说,反熵增思维就是通过一定的方案措施让体系从无序的状态转变成有序的状态。
4、对抗熵增的底层逻辑 想要反熵增,对于“熵”,有一个重要的前提条件—— 熵增是发生在封闭系统之内的 。所以, 避免熵增的有效方法就是,建立一个能和外界不断进行能量和物质交换的、流动的开放系统 。
5、那么我们该如何运用熵减思维为自己的生活、工作和个人发展服务呢? 重点来看熵增这三个关键词,这是熵增的条件: 孤立系统。 无外力做功。 熵增,混乱程度不断增加。
熵增加的反应一定是自发的吗?
1、熵增不一定是自发反应,判断自发反应的方法是G=H-TS,G小于0才自发,所以即使S0,如果H0那么温度够高一样自发。相同物质量气体的熵远比液体固体大,所以如果反应后气体分子数变多可以直接认为熵增。
2、所以当ΔG 0 时,反应是自发的,因为这意味着反应会产生能量。当ΔG 0 时,反应是不自发的,因为这意味着反应需要能量的投入。温度不可能为负是因为温度是一种物理量,它定义了热力学系统中分子运动的速度。
3、不一定都是 追答 并非所有的放热反应都能自发进行,有些放热反应需要加热才能进行。反应一旦开始,释放出的热量就可以使得反应继续下去,而不需要再加热。
常见的熵增反应有哪些?
1、熵说白了就是混乱度,混乱度增加,则熵增大。比如电解水的反应就是一个熵增的过程,液体变成气体,混乱度增大了。固体变成气体,液体的过程都是熵增的。对于气体反应生成气体,则要比较气体前面的系数了。
2、常温的反应的现象为:白色沉淀逐渐消失,同时产生大量气泡,并伴随着大量热的释放,产生的气体能使澄清石灰水变浑浊,由于是稀盐酸,刺激性气味并不明显。该反应可以自发进行,为熵增反应。如果加热,反应会加速进行。
3、熵就是混乱度,混乱度增加,则熵增大。比如电解水的反应就是一个熵增的过程,液体变成气体,混乱度增大了。固体变成气体,液体的过程都是熵增的。对于气体反应生成气体,则要比较气体前面的系数了。
4、的影响.3)熵变(ΔS)值随压力的改变变化也不大,所以可不考虑压力对反应熵变的影响.热力学第二定律告诉我们:在孤立体系中发生的任何变化或化学反应,总是向着熵值增大的方向进行,即熵增的反应有利于反应自发进行。
熵增加的反应一定是自发的吗
1、熵增不一定是自发反应,判断自发反应的方法是G=H-TS,G小于0才自发,所以即使S0,如果H0那么温度够高一样自发。相同物质量气体的熵远比液体固体大,所以如果反应后气体分子数变多可以直接认为熵增。
2、而当反应熵增时 (ΔS 0),反应的 Gibbs 自由能会减少,反应会产生能量。所以当ΔG 0 时,反应是自发的,因为这意味着反应会产生能量。当ΔG 0 时,反应是不自发的,因为这意味着反应需要能量的投入。
3、根据吉布斯自由能方程:△G=△H-T△S,反应要想自发进行,则要求:△G0,即:△H-T△S0。而熵增代表△S 0;放热代表:△H0;结合起来看,△G一定是小于0的,即反应一定自发。
4、因为“对于吸热、熵增的化学反应,高温有利于反应的正向自发进行”,这是一个理论的、定性的说法。
5、多数熵增加的反应在常温常压下均可自发进行。产生气体的反应、气体物质的量增加的反应,熵变都是正值,为熵增加反应。有些熵增加的反应在常温下不能自发进行,但在较高温度下则可自发进行。如碳酸钙的分解。
“熵值增大的反应都能自发进行”为什么是错的?
化学热力学指出,熵增加,焓减小的反应必定是自发反应。自发反应不一定是快速反应。
不一定,需要克服能量堡垒,比如氢气氧气放一起,你不点燃他是不会反应的。
在体系和环境间发生了热交换。从水变成冰的过程中体系放热给环境。环境吸热后熵值增大了,而且环境熵值的增加超过了体系熵值的减小。因而体系的熵变加上环境的熵变仍是大于零的,所以上述自发反应是符合热力学第二定律的。
多数熵增加的反应在常温常压下均可自发进行。产生气体的反应、气体物质的量增加的反应,熵变都是正值,为熵增加反应。有些熵增加的反应在常温下不能自发进行,但在较高温度下则可自发进行。如碳酸钙的分解。
熵增不一定是自发反应,判断自发反应的方法是G=H-TS,G小于0才自发,所以即使S0,如果H0那么温度够高一样自发。相同物质量气体的熵远比液体固体大,所以如果反应后气体分子数变多可以直接认为熵增。
到此,以上就是小编对于熵增加是自发过程的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏