本篇目录:
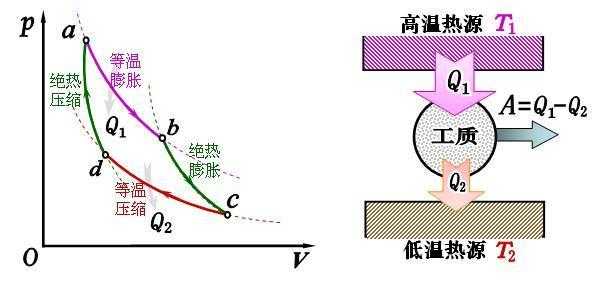
理想气体等温膨胀的规律。
1、所谓等温膨胀就是指一定质量的理想气体在温度不变的条件下缓慢进行的膨胀过程.可见等温膨胀是准静态过程。特征:温度不变,体积增大。
2、气体等温膨胀△S的变化:理想气体向真空膨胀,温度不发生变化,真实气体向真空膨胀,温度一定降低。理想气体经过恒容无非体积功的过程,有ΔH=nCp,mΔT。(假设Cp,m是常数)。
3、根据热力学第一定律ΔU=Q+W,也就是理想气体内能的变化量等于吸放热量与做功量的和。 Q指的是气体吸放热情况,气体吸热,Q取正值;气体放热,Q取负值。
等温膨胀过程到底是怎样的一个过程?
等温过程是热力学过程的一种,即是指热力学系统在恒定温度下发生的各种物理或化学过程。在整个等温过程中,热量的传递使系统与其外界处于热平衡状态。
温度不变,压力减小。 比如一个针筒,在封闭了的情况下,拉开,这就是一个膨胀过程,如果温度不变,那么就是一个等温膨胀的过程。
等温膨胀:所谓等温膨胀就是指一定质量的理想气体在温度不变的条件下缓慢进行的膨胀过程.可见等温膨胀是准静态过程。特征:温度不变,体积增大。
绝热自由膨胀过程中,压强、体积两个量的变化关系的确与等温膨胀中这两个量的变化关系相同,即p2v2=p1v1。定压热容与定体热容的比值称为摩尔热容比,用符号γ表示,大小等于(i+2)/i,其中i是理想气体的自由度。
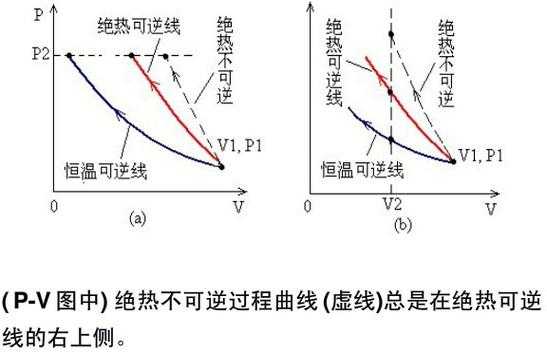
从字面上讲,前者是在恒温的条件下进行的,后者是在一个绝热的条件下进行的。在等温可逆膨胀过程中系统对环境做的功比绝热可逆膨胀做的功大。
不是。等温膨胀时,一定有一个外力拉动活塞使气体膨胀,这个外力就是等温膨胀过程对外界产生的影响,所以不是自发过程。
中考物理辅导--理想气体的内能及其变化
1、理想气体内能变化和焓变的计算公式通常与气体的初始状态和终态有关,而不是关于是否满足了恒容或恒压的条件。这是因为内能和焓是气体状态函数,它们仅取决于气体的初始和终态,而与过程的路径无关。
2、理想气体的内能只与气体的温度有关。气体的内能是分子动能和分子势能的总合,而理想气体分子有质量、无体积,是质量,分子在运动过程中没有相互作用,即无分子势能。
3、初中内能公式:ΔU=W+Q,其中ΔU为内能的变化量,W是外界对系统的做功量,Q是系统从外界的吸热量。理想气体的内能计算公式为E=inRT/2,i是自由度,n是物质的量,R是理想气体常数,T是热力学温度。
到此,以上就是小编对于等温膨胀过程的热量变化规律的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏