本篇目录:
怎样用杂化解释SO3?
三氧化硫中S元素采取sp杂化,在竖直方向(就是没形成杂化轨道剩下的p轨道)上的p轨道中有一对电子,在形成的杂化轨道中有一对成对电子和2个成单电子,有2个氧原子分别与其形成σ键。
这两个氧剩一个单电子的Pz轨道,另外一个O的三个2p轨道电子数分别为0,2,2,那个空的2p轨道是为了接受S的一个SP2杂化轨道的双电子,从而O的一个Pz轨道为两个电子。所以三氧化硫有一个四原子六电子的大π键。
形成了共面的化学键。因此,SO2分子中硫原子采用sp3杂化,而SO3分子中硫原子采用sp2杂化。这样的杂化允许原子能够形成有效的σ键,并保持分子的稳定性和几何构型。
根据价电子构造原理,SO3的中心原子最外层轨道杂化是怎样的?
1、三氧化硫中S元素采取sp杂化,在竖直方向(就是没形成杂化轨道剩下的p轨道)上的p轨道中有一对电子,在形成的杂化轨道中有一对成对电子和2个成单电子,有2个氧原子分别与其形成σ键。
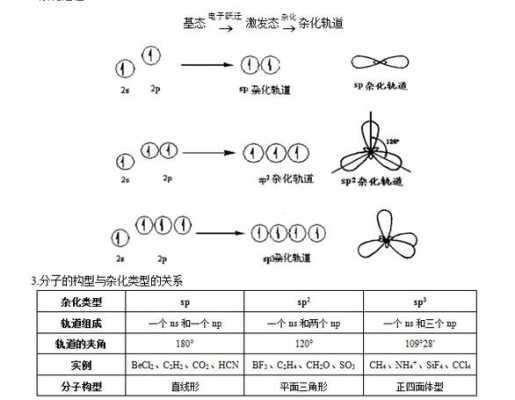
2、过程:在杂化过程中,3s和3p轨道电子必然要发生重新排列,且每个杂化轨道中的s和p成分相同,每个杂化轨道所含有的电子数也应相同。
3、三氧化硫熔沸点均较低,常温下为无色易挥发液体。其气态单分子的空间构型是平面正三角形,分子内所有4个原子均共面。
4、硫为SP2平面三角形结构,由于和三个氧结合,必然至少有3个轨道,而硫最外层有6个电子,氧原子若每个结合两个电子即达稳态,且没有孤对电子,孤对电子不需再占用轨道了,所以只需三个轨道杂化即可,为SP2杂化。
5、一个氧原子与杂化轨道的孤对电子形成配位键,其竖直方向上有2个电子,这样,在4个原子的竖直方向的电子共同形成一套大π键,这套大π键是离域的键。
6、价层电子对互斥原理:用化合物中各原子的价层电子数总和除以二,得到的数就是价层电子对数。其中当氧族元素不是作为中心原子时,氧族元素的价层电子数以0计算。得到的价层电子对数为对应的杂化方式。
三氧化硫杂化轨道图
1、三氧化硫中S元素采取sp杂化,在竖直方向(就是没形成杂化轨道剩下的p轨道)上的p轨道中有一对电子,在形成的杂化轨道中有一对成对电子和2个成单电子,有2个氧原子分别与其形成σ键。
2、SO结构式的成键方式如下。SO分子的平面结构中,S是sp杂化。在竖直方向上的p轨道中有一对电子对,在形成的杂化轨道中有一对成对电子对和2个成单电子,有2个氧原子分别与其形成σ键。
3、SO结构式的成键方式如下:SO分子的平面结构中,S是sp杂化。在竖直方向上的p轨道中有一对电子对,在形成的杂化轨道中有一对成对电子对和2个成单电子,有2个氧原子分别与其形成σ键。
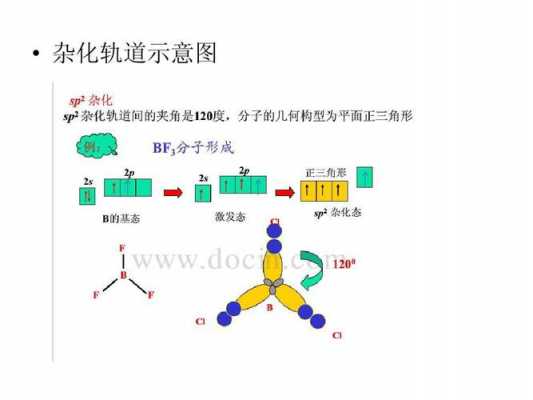
4、带负电荷的加电荷数 带正电荷的减电荷数)整体的一半,记为B A加B等于C C为2 sp杂化 为3 sp2杂化 为4 sp3 杂化。
5、平面三角形结构:三氧化硫,硫是sp2杂化,形成3个等价sp2轨道,键角120度,与氧形成一个sigma键,并且和氧原子p轨道p-π共轭形成4中心6电子的离域大π键。并无配位键。
SO2。SO3杂化方式
1、SO2以及SO3都是sp2杂化。根据VSEPR理论,硫提供六个电子,氧作为配位原子不提供电子,6/2=3,所以都是sp2杂化,这一点毋庸置疑。关于分子构型(不是电子对),SO2是V型,SO3是平面正三角形。
2、SO2(二氧化硫)和SO3(三氧化硫)的杂化方式之所以不同,是由于它们的分子结构和键的形成方式不同。首先,我们来看SO2的结构。在SO2中,硫原子(S)和氧原子(O)形成两个单键。
3、三氧化硫中S元素采取sp杂化,在竖直方向(就是没形成杂化轨道剩下的p轨道)上的p轨道中有一对电子,在形成的杂化轨道中有一对成对电子和2个成单电子,有2个氧原子分别与其形成σ键。
4、SO2的杂化方式是sp2,SO3是sp3杂化。
5、SO结构式的成键方式如下。SO分子的平面结构中,S是sp杂化。在竖直方向上的p轨道中有一对电子对,在形成的杂化轨道中有一对成对电子对和2个成单电子,有2个氧原子分别与其形成σ键。
到此,以上就是小编对于so4杂化的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏